Visuellement propre : éclaircir les directives réglementaires
Par Thomas Altmann, directeur technique international, validation du nettoyage, NEP/NHP

L'expression « visuellement propre » est utilisée dans presque toutes les réglementations pharmaceutiques (FDA, PIC/S, BPF). En clair, les équipements utilisés dans la fabrication de produits pharmaceutiques doivent faire l'objet d'une inspection visuelle pour vérifier leur propreté avant d'être utilisés1.
Cela est parfaitement logique, mais rares sont ceux qui savent exactement ce que signifie la propreté visuelle dans le cadre des procédures normalisées d'exploitation et comment la documenter pour valider le nettoyage. Les questions les plus fréquentes sont les suivantes :
- À quoi ressemblent les résidus?
- Quel est le seuil visuel?
- Comment le matériau de construction affecte-t-il la visibilité?
- À quelle fréquence la vue d'un inspecteur doit-elle être testée?
Vous trouverez ci-dessous une brève explication pour chacune de ces questions.
À quoi ressemblent les résidus?
Vos inspecteurs doivent savoir ce qu'ils recherchent lorsqu'ils inspectent un équipement. Ils devraient au mieux être en mesure de faire la différence entre les résidus de processus et les résidus laissés par les détergents et les produits d'assainissement – et comment se présente un faible niveau de chaque type de résidu. De plus, les inspecteurs doivent savoir à quoi ressemble la surface lorsque visuellement propre, y compris la coloration de l'acier, les rayures ou autres dommages qui n'influencent pas l'étape de production suivante.
Par exemple, les ingrédients actifs apparaissent souvent sous forme de poudres et les résidus de détergents se présentent sous forme de taches sur la surface.

Les ingrédients actifs apparaissent souvent sous forme de poudres.

Les résidus de détergents apparaissent souvent sous forme de taches.
Les résidus de détergents passent souvent inaperçus aux yeux des inspecteurs chargés de la propreté visuelle. Les fabricants de produits pharmaceutiques qui utilisent des détergents conçus pour les applications liées aux aliments et aux boissons doivent savoir que des résidus d'ingrédients non solubles dans l'eau, tels que des inhibiteurs de corrosion ou des surfactants spécifiques, peuvent subsister et créer une interaction inattendue avec les résidus d'ingrédients actifs et être transférés dans le produit fabriqué ultérieurement.
Comment le matériau de construction affecte-t-il l'apparence?
Les résidus peuvent avoir un aspect différent selon le matériau utilisé pour construire l'équipement inspecté. Environ 90 % des équipements utilisés dans la fabrication de produits pharmaceutiques sont en acier inoxydable, le reste étant fabriqué à partir de verre, de caoutchouc et de polymères tels que le téflon et l'EPDM.
Lors de la sélection des équipements et de la formation des inspecteurs, il faut tenir compte du fait qu'il sera plus difficile de repérer les résidus sur les surfaces en polymère que sur les équipements en acier inoxydable.
Cela dit, les équipements en acier inoxydable exposés à une chaleur élevée peuvent se décolorer avec le temps, ce qui rendra l'identification des résidus plus difficile que lorsque l'équipement était neuf. Toutes les surfaces de l'équipement qui sont rayées devront être repolies (si possible) ou remplacées, dès que la propreté visuelle ne peut plus être vérifiée en toute sécurité.

Les inspecteurs doivent être formés pour savoir comment chaque type de résidu apparaît sur chaque type de surface.

L'apparence des résidus peut être affectée par les différents finis des matériaux (acier inoxydable par rapport au téflon ou acier inoxydable neuf/poli par rapport à l'acier inoxydable décoloré).
Quel est le seuil visuel?
Le seuil visuel est le niveau de concentration auquel un ingrédient actif ou un résidu devient visible. Les fabricants doivent déterminer le seuil visuel pour chaque ingrédient actif ou résidu, puis le comparer au niveau auquel cet ingrédient actif ou résidu devient toxicologiquement significatif. Si le seuil visuel est inférieur à votre niveau toxicologiquement significatif prédéterminé pour cet ingrédient actif ou ce résidu de nettoyage, alors la propreté visuelle est une mesure valide.
L'analyse ci-dessous montre la concentration à laquelle le paracétamol (un ingrédient actif à risque relativement faible) devient visible.
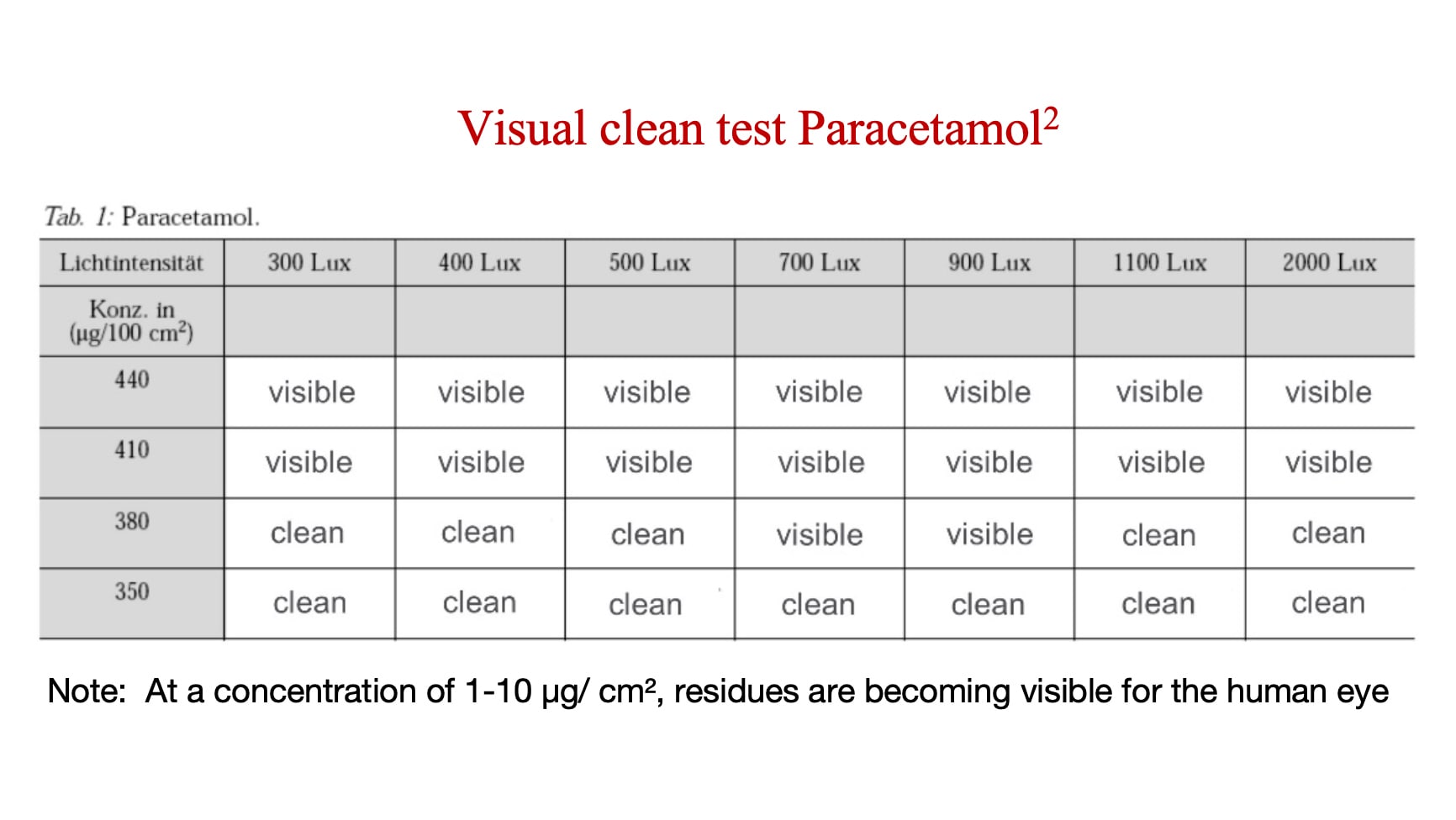
À quelle fréquence la vue d'un inspecteur doit-elle être testée?
Encore une fois, il n'y a pas de directives précises. De nombreuses entreprises exigent désormais que tous les opérateurs qui effectuent des inspections visuelles passent un examen de la vue chaque année.
La loi ne l'exige pas. D'autre part, si vos procédures de nettoyage sont remises en question, le fait de documenter que vous avez fourni une formation approfondie à vos inspecteurs et que vous avez régulièrement testé la vue de vos inspecteurs contribuera grandement à convaincre les organismes de réglementation que vous avez fait tout ce que l'on pouvait raisonnablement attendre de vous.
Des questions supplémentaires?
Pour en savoir plus sur les meilleures pratiques et les directives en matière de propreté visuelle, veuillez communiquer avec la division des sciences biologiques d'Ecolab. Nous sommes présents sur des sites pharmaceutiques dans le monde entier et pouvons fournir de l'information sur la manière dont d'autres fabricants ont introduit la propreté visuelle dans leurs programmes de validation du nettoyage.
1FDA – 21 CFR, partie 211.67, requis au point (6) Inspection de la propreté de l'équipement immédiatement avant son utilisation
2Pharm. Ind. 62, Nr. 6 (2000) Buscalferri et al. − Reinigungsvalidierung


